Česká a slovenská psychiatrie

Časopis
Psychiatrické společnosti ČLS JEP
a Psychiatrickej spoločnosti SLS
souborný článek / review article
KLINICKÝ PŘÍNOS TERAPEUTICKÉHO MONITOROVÁNÍ ANTIPSYCHOTIK PRO PERSONALIZOVANOU MEDICÍNU
CLINICAL BENEFIT OF TDM ANTIPSYCHOTICS FOR PERSONALIZED MEDICINE
Mária Charvátová1, Veronika Krejčí2
1 Psychiatrické oddělení ÚVN - VoFN Praha
2 Odděleni klinické farmacie ÚVN - VoFN Praha
2 Odděleni klinické farmacie ÚVN - VoFN Praha
SOUHRN
Charvátová M, Krejčí V. Klinický přínos terapeutického monitorování antipsychotik pro personalizovanou medicínu
Terapeutické monitorování antipsychotik (TDM - Therapeutic drug monitoring) je specifická metoda pro monitorování terapie pomocí měření plazmatické koncentrace léčiva s následnou interpretací kvalifikovaným odborníkem a akceptací klinikem. Je významným pomocníkem pro personalizovanou medicínu v oblasti individualizace dávkování, protože umožňuje racionalizovat terapii a minimalizovat výskyt nežádoucích účinků, snížit mortalitu a morbiditu a přináší tak snížení celkových nákladů na léčbu. Po vyloučení noncompliance jsou nejpravděpodobnějšími příčinami farmakologické rezistence genetické a exogenní vlivy ovlivňující PC (plasma concentration) léčiv (tzv. pseudofarmakorezistence). Je prokázáno, že mezi pacienty při podání stejné dávky existuje ve farmakokinetice léčiv velká interindividuální variabilita. Díky rozvoji nových analytických metod se TDM stalo v současné době důležitým nástrojem v systému zajišťování kvality farmakoterapie. Je třeba podotknout, že TDM zahrnuje kromě měření koncentrace léčiv rovněž i klinickou interpretaci výsledku, která vyžaduje znalost farmakokinetiky, času odběru vzorku, lékové anamnézy, v neposlední řadě znalost klinického stavu pacienta a specifických laboratorních hodnot odpovídajících biomarkerů. Cílem tohoto sdělení je přispět k rozšíření povědomí o nezbytnosti TDM antipsychotik ve specifických klinických situacích.
Klíčová slova: antipsychotika, farmakorezistence, klinický farmaceut, noncompliance, psychotická porucha, terapeutické monitorování léčiv
SUMMARY
Charvátová M, Krejčí V. Clinical benefit of TDM antipsychotics for personalized medicine
Therapeutic drug monitoring (TDM) is a specific method for monitoring therapy by measuring the plasma concentration of a drug, followed by interpretation by a qualified expert and acceptance by the clinician. It is a significant aid for personalized medicine in the area of dose individualization, as it allows for rational therapy with minimal occurrence of adverse effects, reduced mortality and morbidity, and reduced overall treatment costs. After excluding noncompliance; genetic and exogenous influences affecting plasma drug levels (so-called pseudopharma-coresistance) are the most likely causes of pharmacological resistance. It has been demonstrated that there is a large interindividual variability in drug pharmacokinetics among patients receiving the same dose. Due to the development of new analytical methods, TDM has become an important tool in the system of ensuring the quality of pharmacotherapy. It should be noted that TDM includes not only measurement of drug concentrations, but also clinical interpretation of the results, which requires knowledge of pharmacokinetics, time of sample collection, drug history, knowledge of the patient´s clinical condition, and specific laboratory values corresponding to biomarkers. The aim of this article is to contribute to raising awareness of the necessity of TDM in specific clinical situations.
Key words: antipsychotics, clinical pharmacist, drug resistance, noncompliance, psychotic disorder, therapeutic drug monitoring
ÚVOD
Antipsychotika druhé generace (APG2), známá také jako atypická antipsychotika, jsou léky se širokým spektrem využití v psychiatrii. Nejčastěji se využívají při léčbě psychóz nebo jako stabilizátory nálady. Lze je však využít i při léčbě unipolární deprese, úzkostných poruch, dyssomnických potíží, poruch chování aj.
APG2 jsou považována za první volbu léčby psychotických onemocnění, protože jsou účinnější a mají méně nežádoucích účinků než antipsychotika první generace. APG2 pomohla odstranit některé vážné nežádoucí účinky a nedostatky první generace, což snižuje riziko, že pacienti přestanou léky užívat.
Bohužel i přes obrovský pokrok v terapii psychotických onemocnění za posledních 50 let stále až 30 % pacientů neodpovídá na farmakoterapii.1 Mezi nejčastější příčiny neúčinnosti farmakoterapie patří noncompliance a farmakorezistence. Většina autorit se shoduje na definici farmakorezistence jako neúspěchu nejméně 2 léčebných pokusů s ekvivalentní dávkou > 600 mg chlorpromazinu při ověření účinných plazmatických koncentrací a dostatečné délce terapie (nad 6 týdnů) při setrvalé střední tíži onemocnění a menším než 20% poklesu symptomatologie měřeno mezinárodně uznávanou škálou (PANSS, BPRS, SANS, SAPS).2,3
Psychofarmaka jsou charakterizována nejen vysokou interindividuální variabilitou v důsledku rozdílnosti ve vnitřní výbavě jednotlivců - polymorfismus, ale také v intraindividuální variabilitě (v důsledku např. komorbidit). Genetický polymorfismus podmiňuje odlišný fenotypický projev při metabolizaci léčiva, ovlivňuje jeho biologickou dostupnost, eliminaci a následně i dynamiku jak z hlediska očekávaného účinku, tak z hlediska toxicity.4 Komorbidity mohou ovlivnit mnoho farmakokinetických a farmakodynamických procesů; populační parametry nelze často při farmakoterapii jednotlivého pacienta aplikovat plošně. Proto je TDM, založené na principu měření koncentrace léčiv ve vhodném biologickém materiálu a na komplexní interpretaci klinickým farmaceutem/farmakologem, osvědčeným nástrojem k optimalizaci farmakoterapie a zároveň k minimalizaci potenciálních nežádoucích účinků psychofarmak.5
TDM je definováno jako kvantifikace plazmatické koncentrace (PC - plasma concentration) léčiva za účelem optimalizace dávky. Lze říci, že v ČR v oblasti psychiatrie je TDM stále využíváno relativně málo. TDM je obor, který zahrnuje několik odborných oblastí, je podmíněno interdisciplinárním přístupem, který překračuje úzké hranice jednotlivých odborností.6,7
Dle České psychiatrické společnosti České lékařské společnosti J. E. Purkyně (ČLS JEP)8 je TDM specifická metoda pro monitorování léčby pomocí měření koncentrace léčiva v séru nebo plazmě. Cílem TDM je optimalizace dávkovacího režimu psychofarmak pro pacienta, tj. stanovení nejvhodnější dávky. TDM výrazně snižuje nebezpečí jak předávkování, tak také poddávkování, a tím může ve svém důsledku snižovat náklady na léčbu. Pro některé indikace psychofarmak jsou dnes stanoveny optimální terapeutické koncentrace.6,9
Již dlouho je známo, že plazmatické koncentrace souvisí s terapeutickou odpovědí. Pro tuto skutečnost existuje řada podpůrných argumentů: je známo, že účinnost antipsychotik koreluje s obsazeností D2 receptorů, která by optimálně měla být mezi 60 a 80 %. Obsazenost receptorů zase úzce souvisí s denzitou receptorů a koncentrací léčiva v místě účinku. Zde je dobré zmínit, že ustálené (tzv. steady state, Css) koncentrace dobře korelují s koncentracemi v CNS, a to mnohem lépe, než korelují s dávkami.6,10
ZÁKLADNÍ PRINCIPY TDM V PSYCHIATRII
Zatímco monitorování plazmatických koncentrací stabilizátorů nálady je v praxi rutinně využíváno, TDM antipsychotik (ale i antidepresiv a jiných psychofarmak) zatím zcela běžně využíváno není. V posledních letech se ale v České republice provádění TDM rozšířilo a přibývá laboratoří, kde lze PC nechat stanovit.11,12
Pro většinu běžně užívaných psychofarmak je stanoveno referenční terapeutické rozmezí u antipsychotik obvykle udávané v mg/l8 vymezené spodní hranicí - minimální terapeutická koncentrace, pod níž hrozí neúčinnost léčiva, a horní hranicí - maximální terapeutická koncentrace, po jejímž překročení je výrazně vyšší riziko výskytu nežádoucích účinků a toxicity. Asi dvojnásobkem horní hranice je tzv. "toxická hodnota" (alert level), kdy nastává velké riziko intoxikace. Referenční terapeutické rozmezí je orientační, nelze ho stoprocentně aplikovat na všechny pacienty. Je důležité zdůraznit, že je třeba léčit pacienta jako celek, nikoliv jeho laboratorní hodnoty, případně koncentrace.13
Referenční terapeutická rozmezí antipsychotik jsou stanovena pro pacienty ve věku 18-65 let. Pro děti a seniory tato rozmezí stanovena nejsou. U antipsychotik jsou určena jen pro pacienty s psychotickými poruchami. Není jasné, zda je lze uplatnit např. na pacienty s afektivními poruchami, což je skupina pacientů, která je relativně často antipsychotiky léčena. Tyto hodnoty vycházejí z farmakokinetických studií, jsou orientační a není možné je v praxi aplikovat plošně, proto je důležitá interpretace klinickým farmaceutem ve spolupráci s klinikem, s přihlédnutím k aktuálnímu klinickému stavu pacienta a přidruženým faktorům.
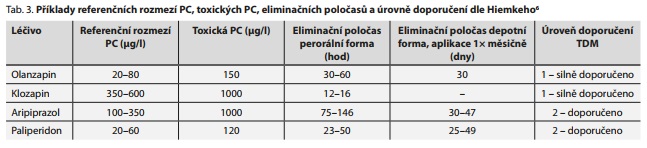
Česká psychiatrická společnost se prakticky shoduje s pracovní skupinou AGNP (Arbeitsgemeinschaft fur Neuropsychopharmakologie und Pharmakopsychiatrie) vedenou profesorem Hiemkem. Rutinní TDM se doporučuje u látek s dobře definovaným terapeutickým referenčním rozmezím a úzkým terapeutickým indexem (např. klozapin, olanzapin, haloperidol aj.) U ostatních psychofarmak se doporučuje TDM ve specifických situacích (tab. 1).5,6,8

Dle AGNP jsou indikace k TDM velmi široké, tímto vlastně doporučuje TDM u většiny pacientů léčených psychofarmaky. Lze říci, že v praxi se takto často (zatím) neprovádějí.
TDM antipsychotik se doporučuje provádět při ustálené PC (Css steady state), tedy nejméně po 5 eliminačních poločasech léčiva podávaného ve stabilní dávce, např. u klozapinu je to asi týden a u olanzapinu až 10 dní. Je potřeba zohlednit i lékovou formu, která může měnit farmakokinetiku samotného léčiva (např. depotní přípravky antipsychotik, tablety s prodlouženým uvolňováním).6 V praxi se odběr vzorků na stanovení PC nejčastěji realizuje v době bezprostředně před aplikací další dávky, kdy dosahují nejnižší koncentrace (trough), pro tyto PC jsou stanovena doporučená terapeutická rozmezí. U depotních přípravků se TDM provádí po dosažení ustálené PC. Vzhledem k odlišné farmakokinetice v tomto případě může trvat týdny až měsíce a odběr se následně provádí před aplikací další dávky.
TDM by mělo být využíváno, pokud indikující lékař dokáže zformulovat konkrétní otázku, na kterou má vyšetření odpovědět.8 Nemělo by se stávat, že bude provedeno TDM u pacienta, který je na stávající dávce léčiva stabilní a nemá nežádoucí účinky, a přesto mu bude snížena dávka jen proto, že zjištěná PC je nad horní hranicí terapeutického rozmezí. Důvodem, proč upravit dávku, by nikdy neměla být jen hodnota PC sama o sobě, ale zhodnocení celkového klinického stavu pacienta. Pokud dojde k upravě dávky jen na základě PC, hrozí dekompenzace. Nejčastější chyby při provádění TDM antipsychotik jsou uvedeny v tabulce 2.13,14
Hiemke6 kromě terapeutických rozmezí široké škály psychofarmak uvádí i jejich úroveň doporučení. U olanzapinu a klozapinu uvádí úroveň 1 (tab. 3). Další antipsychotika, u kterých se TDM silně doporučuje, jsou: amisulprid, haloperidol, perazin, perfenazin a thioridazin. Např. risperidon má úroveň doporučení 2, stejně jako paliperidon, aripiprazol nebo quetiapin.
Je nutné si uvědomit, že cílovým místem působení psychofarmak jsou receptory v CNS. Je nutné brát ohled na individualitu každého pacienta, rozdílné zastoupení cílových receptorů v CNS, i když budou mít dva pacienti stejné PC léčiv, nemusí to znamenat stejnou účinnost psychofarmaka, tj. stejný klinický efekt. Dalším faktem, na který je nutné u TDM antipsychotik myslet, je možnost změny PC bez změny dávky v čase - v závislosti na životosprávě (kouření cigaret, marihuany, abúzus alkoholu, příjem induktorů nebo inhibitorů jaterních enzymů v potravinách, např. třezalka, grapefruit a jiné citrusové plody) a rovněž i v závislosti na věku.15
Použití TDM vede ke zkrácení doby hospitalizace a snížení celkových nákladů na léčbu.16 TDM je i dobrým ukazatelem interdisciplinární spolupráce - nelékařský zdravotnický personál, analytik, klinický farmaceut, resp. farmakolog a klinik. Výsledkem využívání TDM u ambulantních pacientů je snížení počtů hospitalizací, snížení pracovní neschopnosti a zvýšení kvality života.
SPECIFIKA FARMAKOKINETIKY PSYCHOFARMAK
Většina psychofarmak má podobné chemické vlastnosti. Jsou to bazické lipofilní molekuly. Důsledek této podobnosti je podobnost farmakokinetická. Jsou to léčiva, která se dobře vstřebávají z gastrointestinálního traktu (tj. s dobrou biologickou dostupností), se snadným přechodem přes hematoencefalitickou bariéru, s velkým distribučním objemem (Vd), s lineární farmakokinetikou a velká část z nich je metabolizována hepatálními enzymy (nejčastěji za pomoci cytochromu P450, UDP glukuronyltransferázy aj.), z čehož vyplývá jejich náchylnost k lékovým interakcím a relativně pomalá eliminace. Existují ale i výjimky (např. delší/kratší biologický poločas, existence aktivního metabolitu, významná renální eliminace apod.), které je potřeba znát, aby byly výsledky TDM správně interpretovány.7
Dalším důležitým faktorem, jehož znalost je podstatná pro správnou interpretaci výsledků TDM vyšetření, je existence genetického polymorfismu u některých forem cytochromu P450, a to u CYP2D6 (metabolizuje např. aripiprazol) a CYP1A2 (metabolizuje např. klozapin, olanzapin). Jedinci v populaci mohou mít tedy různě funkční (aktivní) alely. V rámci cytochromu CYP2D6 bylo identifikováno na 70 variantních alel. Dále je v současnosti známo více než 40 polymorfismů CYP1A2, přičemž nejméně 7 z nich má dopad na aktivitu CYP1A2 in vivo. Výsledkem je, že v aktivitě těchto izoforem existuje velká interindividuální variabilita, na jejímž základě lze rozdělit populaci na pomalé, středně rychlé, rychlé a ultrarychlé metabolizátory.17 Pomalí metabolizátoři jsou nositeli dvou deficitních alel, proto jsou vystaveni vyššímu riziku toxicity, pokud užívají léčiva, která se primárně metabolizují touto cestou, neboť následně dochází ke kumulaci mateřské látky. Dále hrozí selhání terapie u léčiv, která se tímto způsobem aktivují z proléčiva. A opačně platí, že u ultrarychlých metabolizátorů hrozí neúčinnost léčiv, která jsou metabolizována výhradně jednou ze dvou zmíněných izoforem, a toxicita, pokud jsou touto izoformou aktivována z proléčiva.18
PŘÍKLADY KLINICKÉHO VYUŽITÍ TDM ANTIPSYCHOTIK
Psychofarmaka jsou v praxi používána zhruba od 50. let minulého století a dnes je k dispozici široká škála účinných molekul, s doporučením optimálního dávkování, které vyplývá z výsledků velkých randomizovaných studií (RCTs).19 TDM antipsychotik se již zařadilo do spektra dostupných vyšetření. Na druhou stranu potenciál této metody v oblasti psychiatrie stále nebývá plně využit. Bez provedení TDM je obtížné rozlišit, zda relaps nastal z důvodu neúčinnosti léku, nebo zda pouze nebylo dosaženo dostatečné PC psychofarmaka (tzv. pseudofarmakorezistence), aby se mohlo stát účinným. Příčinou může být také noncompliance pacienta. Významnou roli může hrát též výše zmíněná interindividuální variabilita. Metoda TDM může u těchto pacientů pomoci nastavit optimální dávkování. Nevyužití TDM může vést ke vzniku neracionálních kombinací méně účinných léčiv, k polypragmazii nebo ke vzniku preskripčních kaskád, kdy se k odstranění nežádoucího účinku jednoho léku předepisují další léčiva.
Jak bylo zmíněno výše, klinické využití TDM je vhodné v situacích jako: nedostatečná odpověď na léčbu, podezření na nonadherenci, špatná tolerance léčby či pravděpodobnost významných lékových interakcí. Přehled indikací TDM v psychiatrii přináší tab. 1 (viz výše). V následujícím přehledu budou zmíněny hlavní indikace k TDM,6,8 které budou ilustrovány stručnými kazuistikami. Všechny odběry PC k TDM byly provedeny po ustálení "steady state" koncentrací, pokud není uvedeno jinak.
Komedikace - příklady lékových interakcí, vliv životosprávy
Inhibitory enzymů
Cytochrom P450 1A2 (CYP1A2)
Olanzapin je metabolizován zejména cestou CYP1A2, klozapin CYP1A2 a 3A4, částečně i 2C19. Ciprofloxacin, který je inhibitorem CYP1A2, zvyšuje PC klozapinu asi o 30 %.20
Silným inhibitorem CYP1A2 je antidepresivum ze skupiny SSRI fluvoxamin. Fluvoxamin může zvyšovat PC klozapinu i 5-10krát (kazuistika 1). Dle studie Bergemanna pacienti na olanzapinu léčení zároveň fluvoxaminem měli vyšší PC olanzapinu.21 Dle Gaertnera22 fluvoxamin velmi ovlivňuje PC klozapinu, a to v závislosti na své dávce. Pacienti, kteří užívali fluvoxamin, měli o 82 % vyšší PC klozapinu než pacienti na monoterapii klozapinem.
Kazuistika 1: Léková interakce klozapinu
Muž, 30 let, nekuřák
Dg.: F20.0 paranoidní schizofrenie
OA: hemolytická anémie, cholecystektomie a splenek-tomie v 6 letech, hyperbilirubinémie a spánková apnoe
Medikace vstupně: kyselina acetylsalicylová 100 mg obden, klozapin 350 mg, paroxetin 50 mg, brexpiprazol 4 mg, hydroxyzin 25 mg nebo oxazepam 10 mg při úzkosti, jako druhá volba při úzkosti klonazepam 0,5 mg
Při dimisi: klozapin, aripiprazol, fluvoxamin, bisoprolol, ASA
anamnesticky: sertralin (pro OCD symptomatiku, bez efektu), amisulprid (nežádoucí účinek hyperprolaktinémie)
Popis: 30letý pacient byl léčen od 18 let nejprve s diagnózou F60.3 emočně nestabilní porucha osobnosti, následně byla diagnóza překlasifikována na F20.0 paranoidní schizofrenie. V prosinci 2021 byl hospitalizován na psychiatrickém oddělení po parasuicidiu z psychotické motivace, kdy současně vnímal zhoršení psychického stavu a nově vznikající nežádoucí účinky dosavadní medikace. V klinickém obrazu byla přítomná také OCD symptomatika. Byl ambulantně medikován paroxetinem, klozapinem, brexpiprazolem. Během hospitalizace proběhl mj. switch paroxetinu za fluvoxamin pro sexuální nežádoucí účinky a s cílem potencovat efekt klozapinu zvýšením PC prostřednictvím inhibice CYP1A2 (vysvětlení viz níže, oddíl "LINT klozapin - fluvoxamin").
Výsledky TDM:
1) TDM před nasazením fluvoxaminu (pozn. nejistá compliance v době provedení TDM, viz níže "Interpretace") - klozapin 350 mg/den = 101 ?g/l (350-600), nor-klozapin = 77 ?g/l (100-600);
2) TDM po nasazení fluvoxaminu 100 mg - klozapin 350 mg/den = 1129 ?g/l (350-600), nor-klozapin = 625 ?g/l (100-600);
3) TDM fluvoxamin 100 mg - po redukci klozapinu na 200 mg/den = 558 ?g/l (350-600), nor-klozapin = 386 ?g/l (100-600).
Interpretace: Při vstupním odběru klozapinu byla nejistá compliance pacienta při užívání medikace. Pacient si stěžoval na útlum, pro který vynechával užívání léku ve dnech, kdy podle svých slov potřeboval přemýšlet. Po nasazení fluvoxaminu proběhl druhý odběr, kde se projevil LINT klozapin - fluvoxamin. PC klozapinu byla nad toxickou mezí, ale klinicky se u pacienta neprojevily žádné nežádoucí účinky (EKG v normě, KO+diff v normě, bez epiparoxismu). Následovalo dočasné vysazení klozapinu, po 3 dnech se zahájila postupná titrace do dávky 200 mg pro die (v kombinaci s fluvoxaminem 100 mg), na které byl pacient propouštěn s uspokojivou hodnotou PC na horní hranici terapeutického rozmezí po ustálení steady state a s dobrým klinickým efektem.
LINT klozapin - fluvoxamin: Je nutno uvést, že tato interakce a její vliv na PC klozapinu je velmi dobře známa a popsána v odborné literatuře a může se jevit jako značně riziková, avšak není kontraindikována dle platného SPC. V tomto případě po důkladné klinické rozvaze bylo multi-disciplinárním týmem rozhodnuto o jejím využití v praxi místo navýšení dávky klozapinu s předpokladem benefitu pro pacienta, který z přidání fluvoxaminu mohl v tu chvíli profitovat. Pro doplnění nutno dodat, že pacient tuto kombinaci užíval řadu let za pravidelných kontrol PC klozapinu, dokud nebylo přistoupeno k záměně fluvoxaminu, a to z důvodu dlouhodobých výpadků na trhu. Tato kazuistika může poukázat na to, že i nestandardní a zdánlivě rizikové kombinace interagujících léčiv mohou být využity v klinické praxi za předpokladu důkladného monitoringu negativních dopadů těchto lékových interakci. V tomto konkrétním příkladu byl předpoklad převahy benefitů pro pacienta oproti rizikům vyplývajícím z této kombinace.
Poznámka: Pacient léčbu dobře toleroval. Subjektivně vymizely nepříjemné nežádoucí účinky předchozí medikace. I přes vyšší PC klozapinu nedošlo k nárůstu sedace. Pacient během hospitalizace absolvoval sérii 6 ECT. Forie se výrazně projasnila, anxieta mitigovala. Pacient byl v čase dimise apsychotický, asuicidální, k parasuicidiu kritický.
Zkratky: dg. - diagnóza, OA - osobní anamnéza, ASA - kys. acetylsalicylová, ECT - elektrokonvulzivní terapie, TDM - terapeutické, monitorování léčiv, LINT - léková interakce, NÚ - nežádoucí účinky, TS - tentamen suicidii
Cytochrom P450 2D6 (CYP2D6)
Izoforma CYP2D6 se podílí na metabolizaci asi 30 % léčiv. Polymorfismem CYP2D623,24 může být tedy ovlivněna i účinnost mnoha antidepresiv a antipsychotik. Jako příklad lze uvést aripiprazol nebo bupropion, který je zároveň silným inhibitorem CYP2D6. Významnou vlastností CYP2D6 je jeho inducibilita, tj. jeho aktivita může být zvýšena nebo snížena substrátem, jejž metabolizuje (kazuistika 2). Indukce přetrvává 7-10 dní po vysazení induktoru, kdežto inhibice odeznívá úměrně poločasu eliminace inhibitoru. To je důležité pro posuzování interakcí léčiv, snížení či zvýšení jejich účinku a toxicity.
Kazuistika 2: Léková interakce aripiprazolu
Muž, 29 let
Dg.: F20.0 Paranoidní schizofrenie
OA: porucha přizpůsobení, obezita
Medikace vstupně: depotní aripiprazol 400 mg 1 ampl. i. m. a 4 týdny, quetiapin prolong 400 mg, klonazepam 1 mg
Při dimisi: bupropion 150 mg, quetiapin prolong 400 mg, klonazepam 0,5 mg, depotní aripiprazol 400 mg 1 amp. i. m. a 4 týdny
Popis: Pacient byl přijat na psychiatrické oddělení pro úzkostně depresivní potíže v rámci adaptační poruchy. Stran primárního onemocnění paranoidní schizofrenie byl stav kompenzován. Jedná se o dobře spolupracujícího pacienta na depotní medikaci aripiprazolem. S cílem zmírnit úzkostné příznaky s vegetativním doprovodem byl s dobrým efektem nasazen bupropion v dávce 150 mg. Pacient se rovněž zapojil do terapeutického programu. Bupropion je silným inhibitorem CYP2D6. Aripiprazol je tímto cytochromem majoritně metabolizován, proto bylo provedeno TDM aripiprazolu a bupropionu.
Výsledky TDM: Abilify Maintena (aripiprazol) = 355 ?g/l (100-350), dehydroaripirazol = 92 ?g/l, poměr dehydroaripiprazol/aripirazol (q_MP) = 0, 25 (0,3-0,5), bupropion = 5 ?g/l (10-100), hydroxybupropion = 182 ?g/l (850-1500)
Interpretace: PC aripiprazolu se nacházely u horní hranice terapeutického rozmezí, nižší poměr q_MP může svědčit pro projev inhibice hlavní metabolizační cesty aripirazolu, nebyly známé PC aripiprazolu před nasazením inhibitoru, nešlo tak posoudit míru inhibice metabolismu aripiprazolu. Klinicky byl pacient bez známek NÚ, základní onemocnění bylo dobře kompenzováno, bupropion byl podáván v dávce 150 mg/den, plazmatické koncentrace byly naměřeny pod terapeutickým rozmezím. V případě neuspokojivého klinického stavu je prostor pro navýšení dávky, po němž je nutná opět kontrola PC po ustálení steady state.
Poznámka: V tomto případě po nasazení silného inhibitoru CYP2D6 (bupropionu) dle platných doporučení měla být snížena dávka depotního aripiprazolu na 300 mg a 4 týdny, který je tímto cytochromem majoritně metabolizován, což by ovšem mohlo vést k dekompenzaci základního onemocnění. Proto bylo provedeno TDM s odstupem po ustálení steady state. Klinicky byl pacient na zavedené medikaci stabilní a dobře kompenzovaný, proto byla ponechána dávka depotního aripiprazolu off-label.
Zkratky: dg. - diagnóza, OA - osobní anamnéza, TDM - terapeutické monitorování léčiv, PC - plazmatická koncentrace
Induktory enzymů
Vliv kouření na metabolismus psychofarmak
Kouření tabáku má různé biologické účinky, které představují významné zdravotní riziko. Specifické nebezpečí představují rovněž farmakokinetické interakce s léčivy způsobené složkami cigaretového kouře. Tyto interakce se nevyskytují v případě užívání tabáku a nikotinu jiným způsobem než kouřením. Interakce cigaret a klozapinu či olanzapinu je velmi významná a v praxi častá.
Polycyklické aromatické uhlovodíky jsou produkty neúplného spalování, které se nacházejí v cigaretovém kouři. Interakční metabolické změny vznikají především jejich vlivem, a to tak, že tyto látky zvyšují syntézu cytochromu CYP1A2 a také CYP2E1, čímž zvyšují rychlost biotransformace některých léčiv.25 Z toho plyne, že kuřáci potřebují k udržení optimální PC vyšší dávky klozapinu a olanzapinu než nekuřáci. Respektive pokud bude stejnou dávku užívat kuřák a nekuřák, kuřák bude mít oproti nekuřákovi nižší PC (kazuistika 3). Intenzita metabolické indukce je obecně výraznější u kuřáků, kteří kouří více než 20 cigaret denně. Při plné indukci je metabolická aktivita CYP1A2 zvýšená 1,5-1, 8násobně. Pokud kuřák náhle přestane kouřit, snižuje se postupně enzymová aktivita CYP1A2 a nový ustálený stav vzniká přibližně po uplynutí jednoho týdne.26 TDM antipsychotik je jedním z nástrojů k nastavení adekvátní dávky antipsychotik při zanechání kouření. Umožňuje individualizaci farmakoterapie dle potřeb konkrétního pacienta kombinací kvantifikace koncentrace léčiva v krvi, informací o vlastnosti léčiva a individuálních charakteristik pacienta.6
V souvislosti s kouřením je nutno zmínit, že je nezbytné se v praxi pacientů ptát na jejich kuřáctví/nekuřáctví a mít ponětí i o tom, že pacient začíná nebo přestává kouřit. Právě situace, kdy pacient užívající klozapin nebo olanzapin přestává kouřit, může být nebezpečná, protože na stejných denních dávkách budou pravděpodobně stoupat PC, což může vést až k intoxikaci.27
Kazuistika 3: Vliv životosprávy
Muž, 62 let, kuřák 20 cig./den
Dg.: F25.1 schizoafektivní porucha, depresivní typ
OA: hypertenze na medikaci, anamnesticky škodlivé užívání alkoholu, susp. i benzodiazepinů, hyperlipidémie
Medikace vstupně: venlafaxin 150 mg, klozapin 400 mg, bisoprolol 5 mg
Při dimisi: venlafaxin 150 mg, klozapin 400 mg, atorvastatin 20 mg, acidum folicum 10 mg
Popis: Pacient byl přijat k hospitalizaci pro zhoršení psychického stavu, referoval nevýkonnost, nesoustředěnost, nedostatek energie, obavy o budoucnost. K vyloučení byla organická příčina současného stavu. Na oddělení proběhlo vyšetření somatického stavu včetně zobrazovacího vyšetření mozku. Organicita byla vyloučena. Za adiktologické podpory pacient plánoval odvykat od nikotinismu. Vzhledem k indukci CYP1A2 vlivem cigaretového kouře bylo provedeno TDM klozapinu.
Výsledky TDM: klozapin 400 mg/den = 197 ?g/l (350-600), nor-klozapin = 81 ?g/l (100-600)
Interpretace: PC klozapinu i jeho metabolitu byly pod dolní hranicí terapeutického rozmezí. Noncompliance se jevila spíše nepravděpodobná. Vzhledem k užívané dávce byly PC nízké v. s. na vrub indukce CYP1A2 cigaretovým kouřem. TDM bylo provedeno z důvodu průběžné kontroly, klinicky stav pacienta nevyžadoval úpravu dávky. V případě zanechání kouření nebo při výrazné změně kuřáckých návyků je nutné počítat s nárůstem PC klozapinu cca o 30-50 %, dle současných PC by však terapeutické meze neměly být překročeny.
Poznámka: PC klozapinu byla nižší, k navýšení medikace nebylo přistoupeno, jelikož pacient plánoval přestat s kouřením. Na oddělení došlo k celkovému zlepšení stavu i bez zásahu do medikace.
Zkratky: dg. - diagnóza, OA - osobní anamnéza, TDM - terapeutické monitorování léčiv, PC - plazmatická koncentrace
Compliance a adherence: spolupráce při léčbě
Chronická multifaktoriální onemocnění kladou značné nároky na pacientovu spolupráci. Noncompliance - nespolupráce při léčbě - je rozšířená, například až 60 % pacientů se schizofrenií nedodržuje léčbu. Odhalení nebo potvrzení podezření lékové noncompliance lze považovat za jeden z vůbec nejzásadnějších přínosů TDM. Důvody, pro které pacienti léky neužívají, jsou nejčastěji: popírání nemoci, kognitivní deficit (nepochopení instrukcí, zapomínání), vliv onemocnění (bludy, halucinace - např. hlasy nabádající k neužívání medikace), výskyt nežádoucích účinků (zejm. sexuální nežádoucí účinky, akatizie a hmotnostní přírůstek) nebo obavy z nežádoucích účinků a ze vzniku závislosti na lécích aj.7 TDM lze využít k ověření adherence především v ambulantní sféře, kde je tato metoda jediným efektivním způsobem kontroly nad užíváním perorální medikace pacientem. Nicméně i během hospitalizace někteří pacienti zvládnou léky podané zdravotní sestrou neužívat (kazuistika 4). Pokud se nedostavuje léčebný efekt, často je namístě si klást otázku, zda pacient léky řádně užívá.
Kazuistika 4: Noncompliance
Žena, 54 let, nekuřačka
Dg.: F22.8 jiné trvalé poruchy s bludy, diff. dg.: F20.0 paranoidní schizofrenie
OA: bez somatických komorbidit
Medikace anamnesticky v průběhu hospitalizace: risperidon, paliperidon, olanzapin, haloperidol, extramurálně medikaci neužívala
Popis: Pacientka byla přijata na psychiatrické oddělení pro relaps a progresi psychotického onemocnění. Dlouhodobě byla zcela anosognostická, noncomplientní k užívání medikace a docházení k psychiatrovi. Do medikace byl znovu nasazen olanzapin v dispergovatelné formě. Na základě podezření, že pacientka olanzapin neužívá ani v průběhu hospitalizace, bylo provedeno TDM olanzapinu.
Výsledky TDM:
1) TDM, susp. noncompliance, olanzapin p. o. 20 mg/den = 10 ug/l (20-80), desmethylolanzapin = pod dolní hranicí terapeutického rozmezí (6-24);
2) TDM, zvýšen dohled nad uživáním medikace, olanzapin p. o. 20 mg/den = 67 ?g/l (20-80), desmethylolanzapin = 7 ?g/(6-24), haloperidol 5 mg/den = 6 ?g/l (1?10).
Interpretace: Provedením TDM byla potvrzena noncompliance i během hospitalizace. Nedošlo tak ke zbytnému navýšení dávky olanzapinu z důvodu "pseudo-farmakorezistence". Dostačující bylo zvýšení dohledu a přechodné přidání intramuskulárního haloperidolu. Po 5 dnech pacientka jevila známky sociální úzdravy, zlepšila se spolupráce.
Poznámka: Haloperidol byl následně převeden do perorální formy, olanzapin ponechán v dávce 20 mg pro die. Pacientka byla poté přeložena k následné péči do psychiatrické nemocnice s cílem úplné stabilizace a zlepšení adherence k léčbě.
Zkratky: dg. - diagnóza, OA - osobní anamnéza, TDM - terapeutické monitorování léčiv, PC - plazmatická koncentrace
Dávka
PC antipsychotik jsou ovlivněny podávanou dávkou. Míra korelace PC a dávek vychází v různých studiích různě, ale ve většině studií dávky antipsychotik s PC alespoň částečně korelují. Např. lze uvést, že v metaregresi z 15 olanzapinových studií vyšel u olanzapinu lineární vztah mezi PC a dávkou.28 V praxi lze TDM využít k diferenciální diagnostice předávkování při nejednoznačnosti klinických symptomů, které mohou být jak na vrub progredujícího onemocnění, event. další komorbidity, ale i jako projev příliš vysoké dávky antipsychotika (kazuistika 5).
Kazuistika 5: Vliv dávky na PC
Muž, 35 let
Dg.: F21 schizotypální porucha
OA: gastroezofageální reflux (včetně brániční herniace)
Medikace vstupně: lamotrigin 200 mg, valproát 1600 mg, klomipramin 75 mg, paliperidon 6 mg, depotní paliperidon 150 mg i. m. á 4 týdny, promethazin 25 mg, biperiden 2 mg, quetiapin 200 mg při "ataku"
Při dimisi: valproát 1600 mg, klomipramin 200 mg, paliperidon depot 150 mg i. m. á 4 týdny, promethazin 25 mg, levomepromazin 25 mg při tenzi, hydrogenuhličitan sodný
Popis: 35letý muž s diagnózou schizotypální poruchy byl hospitalizován na psychiatrickém oddělení pro nutkavé auto- a heteroagresivní myšlenky, vtíravé myšlenky "boj dobra se zlem", audiovizuální pseudohalucinace a opakované záchvatovité stavy, během kterých se manifestovaly příznaky podobné okulogyrní krizi. Neurologické konzilium vyloučilo neurologickou etiologii. Recentně před přijetím byl ambulantně nasazen klomipramin, navýšen valproát a k depotnímu paliperidonu přimedikována i jeho perorální forma. Pacient vykazoval mírnou extrapyramidovou symptomatiku (třes, lehké příznaky ozubeného kola, "stropky") , proto bylo provedeno TDM paliperidonu.
Výsledky TDM:
1) TDM, před změnou medikace ambulantním psychiatrem, ověření compliance, paliperidon (Xeplion 150 mg/měs.) = 47 ?g/l (20-60), lamotirgin 200 mg/den = 3 mg/l (3-15), valproát 1000 mg/den = 55 mg/l (50-100), normoalbuminémie;
2) TDM, dif. dg. neurologické obtíže při hospitalizaci na vrub NÚ medikace po navýšení dávek: paliperidon (Xeplion 150 mg/měs. a paliperidon p. o. 6 mg/den) = 80 ?g/l (20-60), valproát 1600 mg/den = 71 mg/l (50-100), normoalbuminémie.
Interpretace: Naměřená PC paliperidonu byla nad terapeutickým rozmezím, PC valproátu v terapeutickém rozmezí, proto bylo přistoupeno k vysazení perorálního paliperidonu.
Poznámka: Lamotrigin byl pro jeho zbytnost vysazen, klomipramin naopak titrován do dávky 200 mg pro die. Po redukci antipsychotika nedošlo k zhoršení psychického stavu, naopak extrapyramidová symptomatika vymizela a pacient byl dimitován ve stavu křehké remise.
Zkratky: dg. - diagnóza, OA - osobní anamnéza, TDM - terapeutické monitorování léčiv, PC - plazmatická koncentrace, NÚ - nežádoucí účinky, AP - antipsychotika
DISKUSE
Použití TDM pro individualizaci léčby psychofarmaky se jeví dle EBM (evidence-based medicine) jako prospěšné. Z literatury jsou známa rozmezí PC, která jsou dosahována při běžně používaných efektivních dávkách, přičemž další evidenci pro uváděné referenční rozmezí poskytují data ze studií obsazenosti receptorů pomocí PET dostupná u některých antipsychotik. Pokud je TDM prováděno uvážlivě a pečlivě interpretováno v kontextu s příslušnými klinickými údaji (nejlépe ve spolupráci zkušeného klinického farmaceuta/farmakologa a žádajícího lékaře), může být cenným nástrojem k optimalizaci léčby. Zjištění, zda je PC léčiva v rozmezí hodnot spojených s vysokou pravděpodobností účinku, představuje první logický krok v léčebné rozvaze u nereagujících nemocných a umožní vyloučit tzv. pseudorezistenci, kdy jsou nedostatečné PC dány korigovatelnými příčinami (špatná adherence, individuální aktivita metabolizujících enzymů, lékové interakce) na rozdíl od skutečné farmakorezistence.
Stanovení PC mateřské látky a metabolitu může být vodítkem při podezření na nonadherenci, farmakokinetickou lékovou interakci či intoxikaci, při výskytu neobvyklé/ nedostatečné odpovědi, při suboptimální toleranci nebo při převodu na jinou lékovou formu léčiva. Limitem tohoto stanovení v rutinní klinické praxi u řady léčiv může být velmi široké rozmezí hodnot poměrů hmotnostních koncentrací či vícero možných fenotypových změn farmakokinetiky. Je možné zvýšit pravděpodobnost dosažení dobré léčebné odpovědi u nonrespondérů s nízkými PC. TDM umožňuje pracovat s faktory, jako je věk, nasazování/vysazování/změna dávky induktoru/inhibitoru metabolické aktivity či porucha hepatálních a renálních funkcí. Terapeutická referenční rozmezí v doporučených postupech je nutné vnímat do jisté míry jako orientační. Jde o konsenzus podložený daty z různých studií s různým designem, počtem a typem subjektů, a nemusí být tudíž aplikovatelný na všechny pacienty. Je proto účelné stanovit individuální "efektivní plazmatické koncentrace" pro další průběh léčby.
ZÁVĚR
TDM antipsychotik se již zařadilo do spektra dostupných vyšetření jak v průběhu hospitalizace, tak i v ambulantní sféře. Lze říci, že potenciál této metody v oblasti psychiatrie stále nebývá plně využit. Klinické zkušenosti psychiatra nemohou vždy stačit k tomu, aby mohly být zodpovězeny všechny otázky ohledně účinnosti farmakoterapie. Dále je zde reálné riziko, že jediným zjevným důkazem neúčinnosti medikace může být relaps onemocnění. Bez provedení TDM je obtížné rozlišit, zda relaps nastal z důvodu neúčinnosti léku, nebo zda nebylo pouze dosaženo dostatečné PC.
Dalším problémem může být nedostatečná informovanost kliniků o potenciálu TDM. Je potřeba se v této oblasti neustále vzdělávat tak, aby metoda TDM mohla být racionálně využívána ve prospěch pacientů.
Je důležité mít vždy před vlastním odběrem PC zformulovaný jasný důvod, proč se vyšetření provádí, a dále je dobré mít na paměti, že výsledná hodnota PC léčiva není bez interpretace výsledku odborníkem plnohodnotnou informací. Provedení TDM je založeno na několika disciplínách, sleduje aspekty farmakokinetické, farmakodynamické, analytické a farmakoekonomické. Samotné určení sérové koncentrace léčiva nelze považovat za dostatečné. Je nezbytné výsledek interpretovat při současném zvážení klinického stavu pacienta a v kontextu ostatních dostupných dat, s přihlédnutím k základní diagnóze a k farmakokinetice podávaného léčiva.
LITERATURA
- 1. Stone JM, Raffin M, Morrison P, McGuire PK. The biological basis of antipsychotic response in schizophrenia. Journal of Psychopharmacology 2010 Jul; 24 (7): 953-964.
- 2. Češková E. Farmakorezistentní schizofrenie. Čes a slov Psychiat 2007; 103: 190-197.
- 3. Juřica J. Vliv genetických a epigenetických faktorů jako kovariátů snášenlivosti a léčebné odpovědi na olanzapin v terapii psychotických onemocnění. Klin Farmakol Farm 2020; 34 (2): 63-69.
- 4. Zhang JP, Malhotra AK. Recent progress in pharmacogenomics of antipsychotic drug response. Curr Psychiatry Rep 2018; Mar 27; 20 (4): 24.
- 5. Šilhán P, Kacířová I, Hýža M et al. Terapeutické monitorování hladin léčiv v psychiatrii - možnosti využití v praxi. Psychiatr praxi 2016; 17: 10-14.
- 6. Hiemke C, Bergemann N, Clement HW et al. Consensus Guidelines for Therapeutic Drug Monitoring in Neuropsychopharmacology: Update 2017. Pharmacopsychiatry 2018; 51: 9-62.
- 7. Taylor D, Barnes TRE, Young AH. The Maudsley Prescribing Guidelines in Psychiatry, 13. vydání. London: Wiley Blackwell 2018.
- 8. Češková E, Šilhán P, Kacířová I et al. Terapeutické monitorování léčiv v psychiatrii. Doporučené postupy psychiatrické péče V. Psychiatrická společnost ČLS JEP 2018. Dostupné online z: Doporučené postupy psychiatrické péče 2018 (psychiatrie.cz).
- 9. Schennach Wolff R, Jäger M, Mayr A, Meyer S, Kuhn KU, Klingberg S, Heuser I et al. Predictors of response and remission in the acute treatment of first episode schizophrenia patientsis it all about early response? Eur Neuropsychopharmacol 2011 May; 21 (5): 370378.
- 10. Perry PJ, Sanger T, Beasley C. Olanzapine plasma concentrations and clinical response in acutely ill schizophrenic patients. J Clin Psychopharmacol 1997; 17: 472-477.
- 11. Mayerová M, Turjap M, Ustohal L, Pivnička J, Češková E. Terapeutické monitorování plazmatických koncentrací olanzapinu a klozapinu. Čes a slov Psychiat 2016; 112 (4): 177-187.
- 12. Češková E, Valášková I, Pindurová E, Žourková A. Farmakogenetické testy a jejich současné využití v psychiatrické praxi. Čes a slov Psychiat 2022; 118 (6): 237-239.
- 13. Tesfaye H. Terapeutické monitorování léčiv v současném pojetí. Remedia 2014; 24: 52-57.
- 14. Grundmann M, Kacířová I. Význam TDM, fenotypizace a genotypizace pro správné dávkování léčiv, Čas Lék čes 2010; 149: 482-487.
- 15. Urban AE, Cubala WJ. Therapeutic drug monitoring of atypical antipsychotics. Psychiatr Pol 2017 Dec 30; 51 (6): 10591077.
- 16. Baldelli S, Cheli S, Montrasio C, Cattaneo D, Clementi E. Therapeutic drug monitoring and pharmacogenetics of antipsychotics and antidepressants in real life settings: A 5year single centre experience. World J Biol Psychiatry 2021; 22: 34-45.
- 17. Nofziger C, Turner AJ, Sangkuhl K et al. PharmVar GeneFocus: CYP2D6. Clin Pharmacol Ther 2020 Jan; 107 (1): 154-170.
- 18. Ďuricová J, Grundmann M. CYP2D6 a jeho klinický význam. Klin Farmakol Farm 2007; 21: 133-136.
- 19. Kacířová I, Grundmann M, Uřinovská R. Obecné zásady terapeutického monitorování hladin psychofarmak. Klin Farmakol Farm 2012; 26: 131-134.
- 20. Raaska K, Neuvonen P. Ciprofloxacin increases serum clozapine and N-desmethylclozapine: A study in patients with schizophrenia. European Journal Of Clinical Pharmacology 2000 Nov; 56 (8): 585-589.
- 21. Bergemann N, Frick A, Parzer P, Kopitz J. Olanzapine plasma concentration, average daily dose, and interaction with comedication in schizophrenic patients. Pharmacopsychiatry 2004 Mar; 37 (2): 63-68.
- 22. Gaertner I, Gaertner H, Lampe D. Therapeutic drug monitoring of clozapine and olanzapine. Similarities and differences. Psychopharmakotherapie 1999 Aug 1; 6 (3): 105-109.
- 23. Bertilsson L, Dahl ML, Dalen P, Al-Shurbaji A. Molecular genetics of CYP2D6: clinical relevance with focus on psychotropic drugs. Br J Clin Pharmacol 2002; 53: 111-122.
- 24. Zanger UM, Raimundo S, Eichelbaum M Cytochrome P450 2D6: overview and update on pharmacology, genetics, biochemistry. Naunyn Schmiedebergs Arch Pharmacol 2004 Jan; 369 (1): 2337.
- 25. Zevin S, Benowitz NL. Drug interactions with tobacco smoking. An update. Clin Pharmacokinet 1999 Jun; 36 (6): 425438.
- 26. Gee SH, Taylor DM, Shergill SS, Flanagan R, MacCabe JH. Effects of a smoking ban on clozapine plasma concentrations in a nonsecure psychiatric unit. Ther Adv Psychopharmacol 2017 Feb; 7 (2): 79-83.
- 27. Tsuda Y, Saruwatari J, Yasui-Furukori N. Meta-analysis: the effects of smoking on the disposition of two commonly used antipsychotic agents, olanzapine and clozapine. BMJ Open 2014; 4 (3): e004216.
- 28. Bishara D, Olofinjana O, Sparshatt A et al. Olanzapine: A systematic review and meta-regression of the relationships between dose, plasma concentration, receptor occupancy, and response. Journal Of Clinical Psycho-Pharmacology 2013 Jun; 33 (3): 329-335.





