Česká a slovenská psychiatrie

Časopis
Psychiatrické společnosti ČLS JEP
a Psychiatrickej spoločnosti SLS
souborný článek / review article
PSYCHONEUROIMUNOLÓGIA DEPRESIE A PERSPEKTÍVY VYUŽITIA BIOMARKEROV V LIEČBE DEPRESÍVNYCH PORÚCH
PSYCHONEUROIMMUNOLOGY OF DEPRESSION AND PERSPECTIVES OF THE USE OF BIOMARKERS IN THE TREATMENT OF DEPRESSIVE DISORDER
Vanda Valkučáková1, Gabriela Bezáková1, Ján Pečeňák1, Ľubomíra Izáková1
1 Psychiatrická klinika LF UK a UNB Staré Mesto, Bratislava, Slovenská republika
SÚHRN
Valkučáková V, Bezáková G, Pečeňák J, Izáková Ľ. Psychoneuroimunológia depresie a perspektívy využitia biomarkerov v liečbe depresívnych porúch
Aberantné zápalové zmeny sú preukázateľne prítomné u pacientov s depresívnou poruchou. Predpokladá sa, že imunitná dysregulácia je relevantným etiopatogenetickým mechanizmom, ktorý zohráva úlohu pri nástupe depresívnej poruchy, ovplyvňuje jej priebeh alebo moduluje liečebnú odpoveď. Vo všeobecnosti sa odhaduje, že jedna tretina pacientov liečených pre recidivujúcu depresívnu poruchu neodpovedá adekvátne na liečbu antidepresívami, pričom sú to práve farmakorezistentní pacienti, u ktorých býva zaznamenávaná zvýšená zápalová aktivita. Pre zlepšenie miery klinickej odpovede, ako aj dlhodobej prognózy pacientov, je nevyhnutné pátrať po nových liečebných stratégiách, s eventuálnou personalizáciou terapie pre pacientov s určitým imunologickým profilom. Dnešné štúdie opakovane potvrdzujú asociáciu medzi periférnymi markermi zápalu v krvi alebo cerebrospinálnom likvore a depresívnymi príznakmi. Do pozornosti vystupujú predovšetkým cytokíny interleukín IL-6, IL-10, tumor nekrotizujúci faktor alfa (TNF-α) a C-reaktívny proteín. Hodnotenie zápalových biomarkerov môže byť užitočným nástrojom v skríningu farmokoterapeuticky rezistentných stavov a zároveň otvára otázku uplatnenia imunologických intervencií v liečbe depresívnych porúch v budúcnosti. Signifikantný antidepresívny efekt býva popisovaný pri užívaní nesteroidných antiflogistík, omega-3-nenasýtených kyselín a statínov. V posledných rokoch sa pozornosť výskumu zameriava na biologické lieky využívané v liečbe systémových autoimunitných ochorení, a to predovšetkým na inhibítory proinflamačných cytokínov, ktoré v klinických štúdiách vykazujú pozitívny efekt na zmiernenie depresívnych symptómov u pacientov so systémovými autoimunitnými ochoreniami. Uvedený príspevok prezentuje aktuálny stav poznatkov o patofyziológii depresie z psychoneuroimunologického pohľadu a perspektíve imunologických intervencií.
Klíčová slova: depresívna porucha, inflamácia, cytokíny, biomarkery zápalu, biomarkery depresie
SUMMARY
Valkučáková V, Bezáková G, Pečeňák J, Izáková Ľ. Psychoneuroimmunology of depression and perspectives of the use of biomarkers in the treatment of depressive disorder
Aberrant inflammatory changes are demonstrably present in patients with depressive disorder. Immune dysregulation is believed to be a relevant etiopathogenetic mechanism that plays a role in the onset of depressive disorder, has impact on its course and modulates treatment response. By estimation one-third of patients treated for recurrent depressive disorder does not respond adequately to antidepressant treatment, and precisely the pharmacoresistant patients do show increased inflammatory activity. It is necessary to search for new treatment strategies in order to improve the rate of clinical response, as well as the long-term prognosis of patients, with personalization of therapy for patients with a certain immunological profile. Current studies repeatedly confirm the association between peripheral markers of inflammation in the blood or cerebrospinal fluid and depressive syndrome. In particular, cytokines IL-6, IL-10, TNFα and C-reactive protein are noted mostly. The evaluation of inflammatory biomarkers can be a useful tool in the screening of pharmacotherapeutically resistant conditions and at the same time brings the question of the application of immunological interventions in the treatment of depressive disorder in the future. A significant antidepressant effect is often described when using non-steroidal anti-inflammatory drugs, omega-3 unsaturated acids and statins. In recent years the research has been focused on biological drugs in the treatment of systemic autoimmune diseases, especially on inhibitors of pro-inflammatory cytokines, which are associated with positive effects on alleviation of depressive symptoms in patients with systemic autoimmune diseases. The article presents current knowledge about the current pathophysiology of depression from a psychoneuroimmunological point of view and the perspective of immunological interventions.
Key words: depressive disorder, inflammation, cytokines, biomarkers of inflammation, biomarkers of depression
AKTIVÁCIA IMUNITNÉHO SYSTÉMU A DEPRESÍVNY SYNDRÓM
Interakcie na úrovni mozgu a imunitného systému sú predmetom systematického výskumu od 70. rokov 20. storočia, kedy sa začal formovať odbor psychoneuroimunológie.1 V roku 1975 Ader a Cohen na animálnom modeli popísali behaviorálne navodenú imunosupresiu, čím bola preukázaná možnosť zmeny aktivity imunitného systému klasickým podmieňovaním správania.2 Obojsmernosť interakcie mozgových a imunitných procesov so zapojením neuroendokrinnej osi demonštroval biologický dôkaz zvýšenia aktivity hypotalamických neurónov v rámci imunitnej odpovede na podanie antigénov.3 Jedným z dôkazov, že imunitný systém prispieva k modulácii mozgových funkcií, je behaviorálna odpoveď organizmu na infekciu, ktorá zahŕňa súbor stereotypných zmien správania, ako je anhedónia, znížená chuť do jedla, narušený spánok, znížená aktivita a sociálne stiahnutie. Tieto zmeny, vo všeobecnosti pomenované ako chorobné správanie (z angl. sickness behavior), sa prekrývajú s časťou symptómov vyskytujúcich sa pri depresívnych poruchách a predpokladá sa, že majú adaptívnu funkciu na zvládnutie choroby a infekcie.4 Experimentálne navodená aktivácia imunitného systému vedie k depresívnemu prežívaniu a zhoršeniu kognitívneho výkonu.5
Depresívny syndróm je častý u pacientov s autoimunitnými a infekčnými chorobami, ako reumatoidná artritída či hepatitída.6 Molekulárny profil chorobného správania a veľkej depresívnej poruchy zahŕňa zvýšenie hladín tých istých pro-inflamačných cytokínov ako interleukíny IL-β, IL-6, TNFα, ktoré bývajú vo zvýšenej miere detegované aj u pacientov s depresívnou poruchou, vrátane elevácie C-reaktívneho proteínu.7 Prítomnosť low-grade zápalu (s CRP > 3 mg/l, < 10 mg/l) sa odhaduje asi u štvrtiny pacientov s depresívnou poruchou.8
Dôkazy poukazujú na spojitosť vyšších hodnôt CRP u depresívnych pacientov s viac závažným stupňom depresie a s telesnými symptómami (únava, zmeny v apetíte, poruchy spánku) než so symptómami, ktoré je možné považovať za psychologicky zrozumiteľné, ako bezmocnosť, excesívne pocity viny a hanby.9 Recentné štúdie navyše ukazujú, že zvýšené hladiny IL-6 a TNF-α pri veľkej depresívnej poruche sú spojené so zvýšenou mikrogliálnou aktivitou v mozgovom parenchýme.10 Okrem veľkej depresívnej poruchy v literatúre nachádzame dôkazy o úlohe zápalu a autoimunitných mechanizmoch aj pri schizofrénii či bipolárnej afektívnej poruche.1
Aktivácia zápalového syndrómu sa považuje taktiež za možný základ rezistencie na antidepresívnu liečbu.11 Aj z tohto pohľadu je signifikantné zodpovedanie otázky, či cielená liečba zápalu (so zameraním na zápalové cytokíny) prináša terapeutický prínos pre pacientov s depresívnou poruchou.
PREPOJENIE ZÁPALU A DEPRESÍVNEHO SYNDRÓMU - KYNURENÍNOVÁ CESTA
Kynurenínová dráha metabolizmu tryptofánu sa pokladala za kľúčový mechanizmus spájajúci zápal s depresiou a závažnosť neuropsychiatrických symptómov sa pripisovala jej aktivácii. Tryptofán, esenciálny aminokyselinový prekurzor serotonínu, môže byť spracovaný dvoma cestami (obr. 1). Prvá, preferenčná, zahŕňa tryptofánhydroxylázu a vedie k produkcii serotonínu. Alternatívnou cestou, najmä pod vplyvom zápalových stavoch spojených so zvýšenými hladinami TNFα, IL-6 a IFN-γ, je tryptofán spracovaný enzýmom indolamín 2, 3-dioxygenázou (IDO), ktorý katalyzuje prvý krok metabolizmu tryptofánu pozdĺž kynurenínovej dráhy.1,12 Kynurenín sa následne metabolizuje na kyselinu kynurenovú (KA) v astrocytoch, oligodendrocytoch a neurónoch alebo na 3-hydroxykynurenín (3-HK), ďalej kyselinu antranilovú, kyselinu 3-hydroxyantranilovú a nakoniec kyselinu chinolínovú (QA) v mikrogliách, makrofágoch a monocytoch. Posledné menované metabolity stimulujú glutamátové N-metyl-D-aspartátové receptory a podporujú oxidačný stres.1
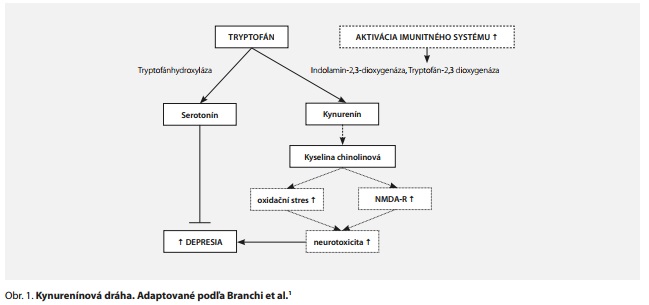
Jedinci postihnutí stavmi, ktoré sú spojené so zvýšenými zápalovými procesmi (napríklad chronické ochorenia, starnutie, zápalové poruchy), vykazujú zvýšenú aktiváciu kynurenínovej dráhy, ktorá vedie k produkcii QA.13 Mechanizmy, ktoré potenciálne tvoria základ úlohy IDO pri poruchách nálady, sú nasledovné:
1. Možné zníženie celkovej syntézy serotonínu v dôsledku preferenčného spracovania tryptofánu kynurenínovou dráhou.
2. Tvorba neurotoxických metabolitov, ako 3-hydroxykynurenín a kyselina chinolínová, ktoré stimulujú glutamátergný systém a vedú k NMDA-receptormi mediovanej excitotoxicite.1
Zápal a následná aktivácia enzýmu metabolizujúceho tryptofán, IDO, sa javia ako dôvod perzistencie symptómov napriek antidepresívnej liečbe u pacientov s depresiou, ktorí vykazujú známky zápalu.14
POSTAVENIE CYTOKÍNOV V ETIOPATOGENÉZE DEPRESIE
Na etiopatogenéze depresie sa podieľa cytokínmi mediovaná komunikácia medzi mozgom a imunitným systémom.4 Názorným príkladom priameho vzťahu medzi cytokínmi a rozvojom depresívneho syndrómu je rozvoj depresívnej poruchy pri liečbe IFN-α, potentným induktorom cytokínov, u pacientov s hepatitídou C: depresívna porucha sa popisuje u 1 zo 4 pacientov.15 Zahájenie liečby paroxetínom pred samotným administrovaním IFN-α efektívne zabraňuje rozvoju depresívnej symptomatológie.16 Metaanalýzy prierezových štúdií potvrdzujú prítomnosť zvýšených hladín cirkulujúcich pro-zápalových cytokínov u pacientov s depresiou,7,17 pričom longitudinálne štúdie dokonca preukazujú, že zvýšené sérové hladiny cytokínov predchádzajú, a teda potenciálne spôsobujú, rozvoj depresívnych symptómov.18 Khandaker et al. popísal od dávky závislý vzťah medzi zvýšenou sérovou hladinou IL-6 v detstve (vo veku 9 rokov) a následným rozvojom depresie v rannej dospelosti (vek 18 rokov).19
Niektoré skôr pozorované účinky cytokínov na mechanizmy súvisiace s depresiou zahŕňajú ich účinky na hypotalamo-hypofyzárnu-nadobličkovú os (HPA).20 Pri akútnom podaní cytokínov, vrátane IL-6, dochádza k stimulácii vylučovania hormónu uvoľňujúceho kortikotropín (CRH) a adrenokortikotropného hormónu (ACTH), čo následne nadmerne aktivuje HPA a následne vedie k zvýšeným hladinám kortizolu, ktoré môžu byť spúšťačom na objavenie sa a/alebo prehĺbenie symptómov depresie.21 Taktiež sa zistilo, že prozápalové cytokíny ovplyvňujú fungovanie neurónov prostredníctvom indukcie vzájomne prepojených abnormálnych reakcií, ako apoptóza a oxidačný stres, ako aj narúšaním procesov synaptickej plasticity a neurogenézy.22
IMUNOMETABOLICKÁ DEPRESIA AKO ŠPECIFICKÝ PODTYP DEPRESIE
V záujme pochopenia spojitosti imunitnej aktivácie a depresie nie je možné vynechať metabolickú dysreguláciu, pretože metabolický syndróm býva častou komorbiditou u pacientov s depresívnou poruchou. Biele tukové tkanivo, špeciálne v abdominálnej oblasti, je aktívnym endokrinným orgánom, produkujúcim zápalové cytokíny a hormóny (napr. leptín), a preto prispieva k imunometabolickej odpovedi v celom organizme, vrátane mozgu. Zápalová aktivácia indukuje inzulínovú rezistenciu, stimuluje leptín-melanokortínovú dráhu, ktorá má dôležitú úlohu v homeostáze metabolizmu lipidov a glukózy. Imunitná aktivácia teda vykazuje silnú obojsmernú súhru s metabolickými a endokrinnými systémami homeostázy, čo potvrdzuje súvislosť vzťahu medzi zápalovými markermi, ako sú CRP a IL-6, vyšším indexom telesnej hmotnosti, tukovou hmotou, hladinami triglyceridov a nižším HDL-cholesterolom.23 Ako dôsledok uvedeného je možné považovať metabolickú a imunitnú dysreguláciu za dve strany tej istej mince - niektoré výskumy používajú kombinované skóre imunometabolickej dysregulácie a berú do úvahy obe dysregulácie súčasne.1
Nezdravý životný štýl, zmeny v mikrobióme, genetické predispozície a potenciálne účinky psychotropných liekov sú faktory, ktoré pravdepodobne prispievajú k metabolickým dysreguláciám pozorovaným u pacientov s depresiou.23 Metabolický syndróm môže čiastočne závisieť od špecifického profilu symptómov depresie. V literatúre sa stretneme s pojmom imunometabolickej depresie, ktorú je možné identifikovať asi u štvrtiny pacientov s depresiou a je charakterizovaná neurovegetatívnymi symptómami, nedostatkom energie, únavovým syndrómom, hyperfágiou, hypersomniou a súbežným zvýšením imunitných markerov (IL-6, TNFα a CRP), ako aj s poruchou neuroendokrinnej a metabolickej signalizácie (dyslipidémia, inzulínová rezistencia, zmena hladiny leptínu).24 Práve u imunometabolickej depresie je nevyhnutné zodpovedať, do akej miery bude táto skupina pacientov profitovať z imunomodulačných terapeutických prístupov.
VPLYV ANTIDEPRESÍV NA AKTIVÁCIU IMUNITNÉHO SYSTÉMU
Predpokladá sa, že antidepresíva znižujú aktiváciu imunitného systému.25 Dôkazy podporujúce túto hypotézu pochádzajú z in vitro štúdií: napríklad tricyklické anti-depresíva, ako je klomipramín a imipramín, pôsobia ako antagonisty prostaglandínu E2, inhibujú syntézu prostaglandínov a znižujú produkciu oxidu dusnatého a TNFa v kultúrach mikrogliálnych a astrocytárnych štruktúr.26 SSRI zoslabujú expresiu cyklooxygenázy (COX)-2 a znižujú hladiny cytokínov, ako je TNFα, IL-6 a IL-1β u pacientov s depresiou.27,28 Široká škála antidepresív, vrátane imipramínu, klomipramínu, venlafaxínu, fluoxetínu, sertralínu a trazodónu, modifikuje pro-/protizápalový pomer v prospech redukcie zápalových markerov vo vzorkách ľudskej krvi.29 Celkovo sa však zdá, že antidepresívny účinok nie je konzistentný a môže závisieť od iných faktorov - predpokladá sa súvislosť s bazálnymi zápalovými hladinami, ktoré definujú účinok antidepresív na imunitný systém: antidepresívny účinok je prozápalový pri nízkych bazálnych hladinách zápalu alebo protizápalový, keď sú bazálne hladiny vysoké.1
Na druhej strane, zvýšená zápalová aktivita znižuje účinnosť antidepresív - potenciálny vplyv zvýšených zápalových hladín na zníženú odpoveď na antidepresívnu liečbu podporuje fakt, že asi jedna tretina depresívnych pacientov vykazuje zvýšené hladiny CRP v sére (> 3 mg /l),30 čo sa prekrýva s jednou tretinou pacientov vykazujúcich rezistenciu na liečbu.31 Vysoká expresia génov súvisiacich s aktiváciou imunitného systému, súvisiaca so vzostupom hladín IL-6, TNFα, faktoru inhibujúceho migráciu makrofágov a IL-1β, v krvi pacientov predikuje nedostatočnú odpoveď na rôzne triedy antidepresív.32 Okrem toho, u pacientov nereagujúcich na liečbu nedochádza k zníženiu hladín TNFα v krvi počas liečby antidepresívami a špecifické polymorfizmy génu IL-1β predpovedajú nedostatočnú reakciu na antidepresívnu liečbu.33 Zvýšené hladiny CRP, považované za celkový biomarker zápalového stavu pacienta, sa vo vyššej miere vyskytujú u jedincov rezistentných na liečbu antidepresívami v rámci populácie depresívnych pacientov.34
VYUŽITIE PROTIZÁPALOVÝCH LIEKOV V LIEČBE DEPRESIEVýskum imunomodulačných terapeutických stratégií v liečbe duševných porúch nie je žiadnou novinkou. Najviac skúmanými zlúčeninami sú nesteroidné protizápalové lieky (NSAID), ako je celekoxib a kyselina acetylsalicylová. Metaanalýza randomizovaných kontrolovaných štúdií (RCT) s nesteroidnými protizápalovými liekmi (NSAID), podávanými ako samostatná alebo adjuvantná liečba k antidepresívam, naznačuje, že môžu byť pri liečbe depresie účinnejšie ako placebo.35 NSAID sú širokospektrálne protizápalové látky, ktoré pôsobia aj na glukokortikoidové receptory, ktoré sú samy o sebe relevantné pre patofyziológiu depresie.36,37 Ich pôsobenie na receptory je však širšie. Preto je nejasné, do akej miery je antidepresívny účinok NSAID spôsobený výlučne protizápalovým pôsobením.38 Niektoré NSAID, ako sú inhibítory cyklooxygenázy-2, zvyšujú riziko kardiovaskulárnych ochorení, čo je známa komorbidita depresie, takže ich paušálne použitie pri depresii môže byť problematické.39 Na tomto mieste je nevyhnutné podotknúť, že mnohé štúdie zamerané na podávanie protizápalových liekov sú realizované u ľudí s primárne somatickým chronickým ochorením - preto je otázne, do akej miery je zlepšenie depresívnych symptómov kauzálne spôsobené úľavou od fyzických ťažkostí.
Odlišnou triedou protizápalových látok sú bioterapeutické monoklonálne protilátky, zlúčeniny schopné blokovať aktivitu dôležitých imunitných "hráčov" vrátane cytokínov, cytokínových receptorov alebo imunitných kontrolných bodov. Cytokínové modulátory, ktoré zahŕňajú monoklonálne protilátky a inhibítory cytokínov, tvoria v porovnaní s NSAID "čistú" protizápalovú triedu, pretože sa zameriavajú na špecifické cytokínové interakcie. Podľa výsledkov početných randomizovaných kontrolovaných štúdií sú cytokínové modulátory efektívnou liečbou pri chronických zápalových ochoreniach, ako napr. reumatoidná artritída a psoriáza.40,41 Mnohé z týchto štúdií hodnotia aj výsledné sekundárne psychosociálne ukazovatele, vrátane depresívnych symptómov, čo naznačuje antidepresívny potenciál anticytokínovej liečby.
Systematický prehľad a metaanalýza vykonaná Kappelmannom et al. ukázala, že anticytokínové lieky, ako sú adalimumab, etanercept, infliximab a tocilizumab, viedli k významnému zmierneniu symptómov depresie.38 Podávanie infliximabu, špecifickej monoklonálnej protilátky proti TNF-α, viedlo k zlepšeniu u pacientov s farmakorezistentnou depresiou, ktorí na začiatku liečby vykazovali vysoké hodnoty zápalu.42 V porovnaní s placebom viedol etanercept k zlepšeniu únavy do 2 týždňov od začiatku štúdie a k zlepšeniu symptómov depresie do 4. týždňa u pacientov so psoriázou, pričom bolo zlepšenie symptómov depresie spojené so zmiernením únavy, ale nie signifikantne s klinickými telesnými prejavmi ochorenia.43
Okrem priamej kvantifikácie antidepresívneho účinku anticytokínovej liečby je na vyjasnenie špecifickej úlohy zápalovej reakcie v etiopatogenéze depresie dôležité skúmanie vzťahu medzi zlepšením depresívnych symptómov vo vzťahu alebo v protipóle k zlepšeniu fyzických symptómov chronických zápalových ochorení.
Zistenia z rozsiahleho systematického prehľadu od Kappelmanna et al., ktorý zahŕňal 20 štúdií vrátane metaanalýzy 16 štúdií s celkovým počtom 5063 účastníkov, indikujú, že liečba anticytokínmi zlepšuje symptómy depresie. V súvislosti s predikciou liečebnej odpovede bol antidepresívny účinok spojený so závažnosťou symptómov depresie na začiatku sledovania, ale nie so zlepšením fyzického ochorenia, a to nezávisle od pohlavia a veku účastníkov alebo trvania štúdie.38 Zlepšenie nálady teda nie je len artefaktom úľavy od telesných príznakov po liečbe anticytokínmi. Výsledky poskytujú dôležité vodítka týkajúce sa úlohy zápalových cytokínov pri depresii a potenciálu cytokínových modulátorov v liečbe depresie. Blokovanie TNF-α etanerceptom u myší zabraňuje správaniu podobnému depresii po vystavení zápalovým stimulom alebo stresu.44
V budúcnosti sú potrebné RCT anticytokínovej liečby zacielené primárne na depresiu u jedincov s vysokým zápalom, ktorí nemajú iné telesné ochorenia. Ako populácia vhodná pre randomizované klinické štúdie modulátorov cytokínov sa z viacerých dôvodov javí skupina pacientov s depresiou rezistentnou na liečbu a zároveň so zvýšenými hladinami zápalových markerov.
Podávanie monoklonálnych protilátok so sebou však prináša riziko nežiaducich imunitných reakcií, ako je akútna anafylaxia, ako aj rôznych špecifických nežiaducich účinkov vrátane zvýšeného rizika infekcií, rakoviny a autoimunitných ochorení.45 Pre uvedené dôvody je nevyhnutnosťou zodpovedanie otázky bezpečnosti a znášanlivosti týchto liekov u pacientov s depresiou.
Ďalším potenciálnym liekom s antidepresívnym účinokom je minocyklín.46 Ide o tetracyklínové antibiotikum druhej generácie s antioxidačnými, protizápalovými a neuroprotektívnymi účinkami. V uvedenej metaanalýze sa však zaznamenal jeho účinok len pri veľkej depresívnej poruche a nepreukázal sa pri bipolárnej depresii, čo naznačuje, že tento liek nemožno využiť na liečbu všetkých typov porúch nálady.47
Medzi potenciálne nové spôsoby liečby depresie možno zaradiť omega-3 polynenasýtené mastné kyseliny (omega-3 MK), ktoré vykazujú protizápalové účinky. Výsledky z rôznych metaanalýz ukazujú, že suplementácia omega-3 MK je prospešná u pacientov s depresiou, ktorí sú liečení antidepresívami.48 Antidepresívny a antiimflamačný účinok sa tiež popisuje u statínov, ktoré sa bežne používajú pri hypercholesterolémii a majú protizápalové vlastnosti. Použité boli v liečbe veľkej depresívnej poruchy samotné, alebo v kombinácii so SSRI. Zistilo sa, že tieto lieky nemajú negatívny vplyv u jedincov bez depresie, ale u pacientov s depresiou môžu mať vplyv na zmiernenie jej symptómov.49
V rámci antiimflamačného ovplyvnenia depresie prichádza do úvahy aj použitie ketamínu, ako nekompetitívneho antagonistu NMDA receptorov s protizápalovým pôsobením. Podanie ketamínu znižuje aktivitu IDO a pomer kynurenín/tryptofán. Čo sa týka špecifického účinku na zápalové mediátory, animálne modely depresie na myšiach preukázali, že podávanie ketamínu znížilo hladiny IL-6, TNF-α a IL-1β.50,51 U pacientov s farmakorezistentnou depresiou dôkaz uvedených zápalových abnormalít môže predpovedať výsledok liečebnej odpovede na podanie ketamínu.
VYUŽITIE BIOMARKEROV
Špecifické, klinicky rutinne využiteľné biomarkery depresívnych porúch doteraz neboli definované. Vzhľadom k súčasným poznatkom sa dá očakávať, že nepôjde o jeden biomarker, ale skupinu state a trait biomarkerov. Početné štúdie ukázali, že prozápalové cytokíny by medzi ne mali patriť. Výskumy preukázali ich zvýšené hladiny v periférnej krvi pacientov s MDD, ide o IL-1β, IL-6, TNF-α, IL-10, sIL-2R, MCP-1, IL-13, IL-18, IL-12, IL-1ra a solubilný TNF-α receptor.20,52 Ich asociácia s depresívnou symptomatikou môže viesť k definovaniu state markera depresívnej poruchy s potrebou opakovaného stanovovania ich hladín. Niekoľko nedávnych výskumov skúmalo možnosť použitia slín v detekcii cytokínov. Vzorky slín možno ľahko a opakovane odoberať minimálne invazívnym spôsobom. Z tohto hľadiska môžu sliny slúžiť ako ideálny zdroj vzoriek pri výskume cytokínov pri MDD. Navyše sa ukazuje, že miera detekcie cytokínov je vo všeobecnosti vyššia v slinách v porovnaní so sérom.53 Hladiny IL-1β, IL-6, IL-12 a IL-13 v slinách boli tiež významne vyššie u pacientov s MDD ako u zdravých kontrol.54 Napriek naliehavej potrebe zavedenia relevantných klinických biomarkerov pre diagnostiku duševných porúch do klinickej praxe je ich výskum brzdený predovšetkým klinickou heterogenitou populácie pacientov a nedostatočnou metodologickou štandardizáciou.55
ZÁVER
Neoddeliteľnosť imunitných a mozgových funkcií v etiopatogenéze depresívnej poruchy prináša dôležité indície k smerovaniu nových diagnostických a terapeutických stratégií. Psychoneuroimunologický pohľad zdôrazňuje, akú sprostredkovateľskú úlohu môže zohrávať zápal v širších interakciách, a otvára dvere novovznikajúcej disciplíne imunopsychiatrie, ktorá prináša so sebou viaceré výzvy. Bude možné identifikovať spoľahlivé biomarkery depresie?
Bedeme vedieť predikovať prognózu liečebnej odpovede podľa imunitno-zápalového profilu pacienta? Budeme v budúcnosti využívať imunomodulačnú liečbu za účelom zlepšenia efektívnosti antidepresívnej liečby? Na základe súčasných poznatkov je preukázané, že proinflamačné cytokíny zohrávajú aktívnu úlohu v patogenéze depresie. Navyše poukazujú na možnú účinnosť anticytokínovej liečby u určitého podtypu pacientov s depresiou, najmä v prípadoch rezistentných na liečbu so súbežne prítomnými zvýšenými známkami zápalu. Aktivácia imunitného systému ovplyvňuje účinnosť antidepresív a naznačuje, že stratifikácia pacientov s depresiou podľa profilu zápalových biomarkerov má potenciál oddeliť respondentov a neodpovedajúcich, čo by mohlo prispieť k efektívnosti terapeutických intervencií. Zameranie sa na zápalové procesy má potenciál k smerovaniu preventívnych a terapeutických stratégií v komplexnej starostlivosti o duševné zdravie. Budúcnosť imunopsychiatrického smerovania otvára ďalšiu z relevantných ciest k personalizovanej a precíznej psychiatrickej praxi.
LITERATÚRA
- 1. Branchi I, Poggini S, Capuron L et al. Brain-immune crosstalk in the treatment of major depressive disorder. Eur Neuropsychopharmacol 2021; 45: 89-107.
- 2. Ader R, Cohen N. Behaviorally conditioned immunosuppression. Psychosom Med 1975; 37 (4): 333-340.
- 3. Besedovsky HO, Del Rey AE, Sorkin E. What do the immune system and the brain know about each other? Immunol Today 1983; 4 (12): 342-346.
- 4. Dantzer R. Depression and inflammation: an intricate relationship. Biol Psychiatry 2012; 71 (1): 4-5.
- 5. Reichenberg A, Yirmiya R, Schuld A, Kraus T, Haack M, Morag A et al. Cytokine-associated emotional and cognitive disturbances in humans. Arch Gen Psychiatry 2001; 58: 445-452.
- 6. Benros ME, Waltoft BL, Nordentoft M et al. Autoimmune diseases and severe infections as risk factors for mood disorders: a nationwide study. JAMA Psychiatry 2013; 70 (8): 812-820.
- 7. Goldsmith DR, Rapaport MH, Miller BJ. A meta-analysis of blood cytokine network alterations in psychiatric patients: comparisons between schizophrenia, bipolar disorder and depression. Mol Psychiatry 2016.
- 8. Osimo EF, Baxter LJ, Lewis G, Jones PB, Khandaker GM. Prevalence of low-grade inflammation in depression: a systematic review and meta-analysis of CRP levels. Psychol Med 2019; 49 (12): 1958-1970.
- 9. Kohler-Forsberg O, Buttenschon HN, Tansey KE et al. Association between C-reactive protein (CRP) with depression symptom severity and specific depressive symptoms in major depression. Brain Behav Immun 2017; 62: 344-350.
- 10. Enache D, Pariante CM, Mondelli V. Markers of central inflammation in major depressive disorder: a systematic review and meta-analysis of studies examining cerebrospinal fluid, positron emission tomography and post-mortem brain tissue. Brain Behav Immun 2019; 81: 24-40.
- 11. Carvalho LA, Torre JP, Papadopoulos AS, Poon L, Juruena MF, Markopoulou K et al. Lack of clinical therapeutic benefit of antidepressants is associated overall activation of the inflammatory system. J Affect Disord 2013; 148: 136140.
- 12. O´Connor JC, Andre C, Wang Y, Lawson MA, Szegedi SS, Lestage J et al. Interferon-gamma and tumor necrosis factor-alpha mediate the upregulation of indoleamine 2,3-dioxygenase and the induction of depressive-like behavior in mice in response to bacillus Calmette-Guerin. J Neuroscience 2009; 29: 4200-4209.
- 13. Capuron L, Fornwalt FB, Knight BT, Harvey PD, Ninan PT, Miller AH. Does cytokine-induced depression differ from idiopathic major depression in medically healthy individuals? J Affect Disord 2009; 119: 181-185.
- 14. Christmas DM, Potokar J, Davies SJ. A biological pathway linking inflammation and depression: activation of indoleamine 2,3-dioxygenase. Neuropsychiatr Dis Treat 2011; 7: 431-439.
- 15. Udina M, Castellvi P, Moreno-Espana J, Navines R, Valdes M, Forns X et al. Interferon-induced depression in chronic hepatitis C: a systematic review and meta-analysis. J Clin Psychiatry 2012; 73: 1128-1138.
- 16. Kraus MR, Schafer A, Faller H, Csef H, Scheurlen M. Paroxetine for the treatment of interferon-alpha-induced depression in chronic hepatitis C. Aliment Pharmacol Ther 2002; 16: 10911099.
- 17. Haapakoski R, Mathieu J, Ebmeier KP, Alenius H, Kivimaki M. Cumulative meta-analysis of interleukins 6 and 1 beta, tumour necrosis factor alpha and C-reactive protein in patients with major depressive disorder. Brain Behav Immunity 2015; 49: 206-215.
- 18. Gimeno D, Kivimaki M, Brunner EJ, Elo-vainio M, De Vogli R, Steptoe A et al. Associations of C-reactive protein and interleukin-6 with cognitive symptoms of depression: 12-year follow-up of the Whitehall II study. Psychol Med 2009; 39: 413-423.
- 19. Khandaker GM, Pearson RM, Zammit S, Lewis G, Jones PB. Association of serum interleukin 6 and C-reactive protein in childhood with depression and psychosis in young adult life: a population-based longitudinal study. JAMA Psychiatry 2014; 71: 1121-1128.
- 20. Besedovsky HO, del Rey A. Immune-neuro-endocrine interactions: facts and hypotheses. Endocr Rev 1996; 17 (1): 64-102.
- 21. Miller AH, Maletic V, Raison CL. Inflammation and its discontents: the role of cytokines in the pathophysiology of major depression. Biol Psychiatry 2009; 65 (9): 732-741.
- 22. Zunszain PA, Hepgul N, Pariante CM. Inflammation and depression. Curr Top Behav Neurosci 2013; 14: 135-151.
- 23. Lamers F, Milaneschi Y, Vinkers CH, Schoevers RA, Giltay EJ, Penninx BWJH. Depression profilers and immuno-metabolic dysregulation: longitudinal results from the NESDA study. Brain Behav Immun 2020; 88: 174-183.
- 24. Milaneschi Y, Simmons WK, van Rossum EFC, Penninx BW. Depression and obesity: evidence of shared biological mechanisms. Mol Psychiatry 2019; 24: 18-33.
- 25. Galecki P, Mossakowska-Wójcik J, Talarowska M. The anti-inflammatory mechanism of antidepressants - SSRIs, SN-RIs. Prog Neuropsychopharmacol Biol Psychiatry 2018; 80 (Pt C): 291-294.
- 26. Wang K, Ye L, Lu H et al. TNF-a promotes extracellular vesicle release in mouse astrocytes through glutaminase. J Neuroinflammation 2017; 14 (1): 87.
- 27. Taler M, Gil-Ad I, Lomnitski L, Korov I, Baharav E, Bar M, Zolokov A, Weizman A. Immunomodulatory effect of selective serotonin reuptake inhibitors (SSRIs) on human T lymphocyte function and gene expression. Eur Neuropsychopharmacol 2007; 17: 774-780.
- 28. Hannestad J, DellaGioia N, Bloch M. The effect of antidepressant medication treatment on serum levels of inflammatory cytokines: a meta-analysis. Neuropsychopharmacology 2011 Nov; 36 (12): 2452-2459.
- 29. Kopschina Feltes P, Doorduin J, Klein HC et al. Anti-inflammatory treatment for major depressive disorder: implications for patients with an elevated immune profile and non-responders to standard antidepressant therapy. J Psychopharmacol 2017; 31 (9): 1149-1165.
- 30. Wium-Andersen MK, Orsted DD, Nielsen SF, Nordestgaard BG. Elevated C-reactive protein levels, psychological distress, and depression in 73, 131 individuals. JAMA Psychiatry 2013; 70: 176-184.
- 31. Carvalho LA, Torre JP, Papadopoulos AS, Poon L, Juruena MF, Markopoulou K et al. Lack of clinical therapeutic benefit of antidepressants is associated overall activation of the inflammatory system. J Affect Disord 2013; 148: 136140.
- 32. Arteaga-Henríquez G, Simon MS, Burger B et al. Low-grade inflammation as a predictor of antidepressant and anti-inflammatory therapy response in MDD patients: a systematic review of the literature in combination with an analysis of experimental data collected in the EU-MOODINFLAME Consortium. Front Psychiatry 2019; 10: 458.
- 33. Yu YW, Chen TJ, Hong CJ, Chen HM, Tsai SJ. Association study of the interleukin-1 beta (C-511T) genetic polymorphism with major depressive disorder, associated symptomatology, and antidepressant response. Neuropsychopharmacology 2003; 28 (6): 1182-1185.
- 34. Chamberlain SR, Cavanagh J, de Boer P et al. Treatment-resistant depression and peripheral C-reactive protein. Br J Psychiatry 2019; 214 (1): 11-19.
- 35. Muller N, Schwarz MJ, Dehning S, Douhe A, Cerovecki A, Goldstein-Muller B et al. The cyclooxygenase-2 inhibitor celecoxib has therapeutic effects in major depression: results of a double-blind, randomized, placebo controlled, add-on pilot study to reboxetine. Mol Psychiatry 2006; 11: 680-684.
- 36. Hu F, Wang X, Pace TW, Wu H, Miller AH. Inhibition of COX-2 by celecoxib enhances glucocorticoid receptor function. Mol Psychiatry 2005; 10: 426-428.
- 37. Pariante CM, Miller AH. Glucocorticoid receptors in major depression: relevance to pathophysiology and treatment. Biol Psychiatry 2001; 49: 391-404.
- 38. Kappelmann N, Lewis G, Dantzer R, Jones PB, Khandaker GM. Antidepressant activity of anti-cytokine treatment: a systematic review and meta-analysis of clinical trials of chronic inflammatory conditions. Mol Psychiatry 2018 Feb; 23 (2): 335-343.
- 39. Mukherjee D, Nissen SE, Topol EJ. Risk of cardiovascular events associated with selective COX-2 inhibitors. JAMA 2001; 286: 954-959.
- 40. Reich K, Burden AD, Eaton JN, Hawkins NS. Efficacy of biologics in the treatment of moderate to severe psoriasis: a network meta-analysis of randomized controlled trials. Br J Dermatol 2012; 166: 179-188.
- 41. Aaltonen KJ, Virkki LM, Malmivaara A, Konttinen YT, Nordstrom DC, Blom M. Systematic review and meta-analysis of the efficacy and safety of existing TNF blocking agents in treatment of rheumatoid arthritis. PloS One 2012; 7: e30275.
- 42. Raison CL, Rutherford RE, Woolwine BJ, Shuo C, Schettler P, Drake DF et al. A randomized controlled trial of the tumor necrosis factor antagonist infliximab for treatment-resistant depression: the role of baseline inflammatory biomarkers. JAMA Psychiatry 2013; 70: 31-41.
- 43. Tyring S, Gottlieb A, Papp K, Gordon K, Leonardi C, Wang A et al. Etanercept and clinical outcomes, fatigue, and depression in psoriasis: double-blind placebo-controlled randomised phase III trial. Lancet 2006; 367: 29-35.
- 44. Liu YN, Peng YL, Liu L et al. TNFa mediates stress-induced depression by upregulating indoleamine 2,3-dioxygenase in a mouse model of unpredictable chronic mild stress. Eur Cytokine Netw 2015; 26 (1): 15-25.
- 45. Hansel TT, Kropshofer H, Singer T, Mitchell JA, George AJ. The safety and side effects of monoclonal antibodies. Nat Rev Drug Discov 2010; 9: 325-338.
- 46. Rosenblat JD, McIntyre RS. Efficacy and tolerability of minocycline for depression: a systematic review and meta-analysis of clinical trials. J Affect Disord 2018; 227: 219-225.
- 47. Husain MI, Chaudhry IB, Khoso AB et al. Minocycline and celecoxib as adjunctive treatments for bipolar depression: a multicentre, factorial design randomised controlled trial. Lancet Psychiatry 2020; 7 (6): 515-527.
- 48. Mocking RJ, Harmsen I, Assies J, Koeter MW, Ruhé HG, Schene AH. Meta-analysis and meta-regression of omega-3 polyunsaturated fatty acid supplementation for major depressive disorder. Transl Psychiatry 2016; 6 (3): e756.
- 49. Kohler-Forsberg O, Otte C, Gold SM, 0stergaard SD. Statins in the treatment of depression: Hype or hope? Pharmacol Ther 2020; 215: 107625.
- 50. Wang N, Yu HY (Besedovsky & Rey, 1996; Kohler et al., 2017), Shen XF et al. The rapid antidepressant effect of ketamine in rats is associated with down-regulation of pro-inflammatory cytokines in the hippocampus. Ups J Med Sci 2015; 120 (4): 241-248.
- 51. Kiraly DD, Horn SR, Van Dam NT et al. Altered peripheral immune profiles in treatment-resistant depression: response to ketamine and prediction of treatment outcome. Transl Psychiatry 2017; 7 (3): e1065.
- 52. Kohler CA, Freitas TH, Maes M et al. Peripheral cytokine and chemokine alterations in depression: a meta-analysis of 82 studies. Acta Psychiatr Scand 2017; 135 (5): 373-387.
- 53. Byrne ML, O´Brien-Simpson NM, Reynolds EC et al. Acute phase protein and cytokine levels in serum and saliva: a comparison of detectable levels and correlations in a depressed and healthy adolescent sample. Brain Behav Immun 2013; 34: 164-175.
- 54. Yui S, Sasayama D, Yamaguchi M, Washizuka S. Altered levels of salivary cytokines in patients with major depressive disorder. Clin Neurol Neurosurg 2022; 221: 107390.
- 55. De Picker LJ. The future of immunopsychiatry: three milestones to clinical innovation. Brain Behav Immun Health 2021; 16: 100314.





